대표적 산화물계 고체전해질 4종류
Perovskite, Garnet, NASICON, LAGP
안녕하세요! WAB입니다.
오늘은 산화물계 고체전해질의 종류와 예상 적용분야에 관해서 살펴보겠습니다.
바로 이전 시간에는 산화물계 고체전해질의 전반적 특징에 대해 알아보았습니다.
하지만 산화물계 고체전해질의 종류에 따라 특징이 조금씩 달라지기 때문에,
어떠한 종류가 있는지, 종류별 차이는 어떤지 알아야 하겠죠?!
추가적으로 산화물계 고체전해질의 합성법에 대해 간략하게도 설명드리겠습니다!
전고체배터리(ASSB) : 산화물계 고체전해질 장점과 단점
장점은 대기안정성과 높은 전위창단점은 낮은 이온전도도안녕하세요! WAB입니다.오늘은 산화물계 고체전해질에 관해서 살펴보겠습니다.이전 시간에는 황화물계 고체전해질의 종류와 장단점에
wearethebattery.tistory.com
산화물계 고체전해질 종류
1. Perovskite 계
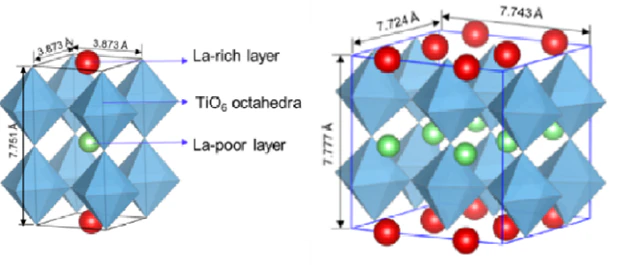
ABO3 구조로, Pm-3m 구조와 P4/mmm 등의 구조가 섞여 있으며, 일반적으로 산화물계 물질들 중 비교적 높은 이온전도도를 가집니다.
일반적으로 Pm-3m 구조는 Li+와 La3+가 무작위(disordered)로 A 자리에 분포되어 있으며, P4/mmm 구조는 c-axis를 따라 La3+의 농도가 높고 Li+의 빈자리가 많은 층이 교대로 배열되어 있습니다.(ordered)
대표적 소재인 LLTO (Li3xLa2/3-xTiO3)는 약 1mS/cm 1mS/cm의 이온전도도를 갖는데, 이온전도 메커니즘은 층을 이루고 있는 각 La3+ layer와 그 사이에 존재하는 octahedral TiO6의 정전기적 인력으로 발생합니다.
즉, La2/3TiO3 구조의 각 La-rich와 La-poor site에서의 불규칙한 La 이온의 배치로 인해 구조의 약한 distortion이 발생하고, 이러한 격자 결함으로 인해 리튬 이온이 이동할 수 있는 경로가 형성되죠. 더욱이 LLTO는 grain boundary 저항이 매우 크기 때문에 bulk와 시료 전체(total)의 이온 전도도가 다릅니다.
이 물질은 무엇보다도 연료전지 및 화학 반응기에서 이미 사용되고 있지만, Perovskite계는 Garnet계 또는 NASICON계에 비해 명확한 이점이 없습니다. 다만, 과거에는 LISICON 계열에 이어 다른 두 가지 계열보다 먼저 연구되었기 때문에 LISICON에 비해 상대적으로 높은 전도성으로 인해 잠깐이나마 유망하다고 생각했었습니다.
이 소재의 열 안정성은 NASICON계 산화물보다 높지만 Garnet계 산화물보다 낮습니다. 약 250°C 온도에서 약간의 열폭주현상이 발생한다고 보고되었습니다.
리튬금속과의 compatibility의 경우, 안정적이지 않으며 환원 과정에서 분해되는 특성(단점)이 있습니다.
2. Garnet 계
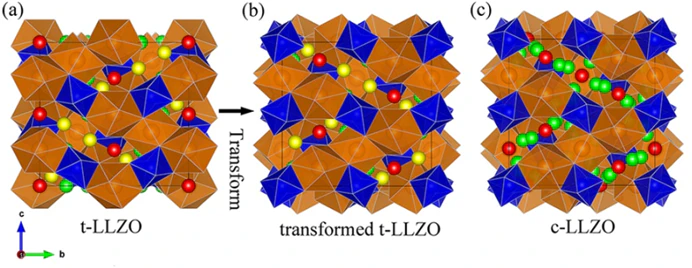
Garnet계는 산화물계에서 가장 잘 알려지고 가장 유망한 물질입니다. Garnet계 고체전해질은 Li6ALa2Ta2O12 (A=Sr, Ba) 조성으로 처음 개발되었으며 '05년에 4 x 10^-2 mS/cm의 이온 전도도를 달성 후, Li7La3Zr2O12 (LLZO) 조성으로 최적화한 후 약 1mS/cm의 이온 전도도를 달성하게 되었죠.
이 소재의 장점은 넓은 전기화학적 전위창(electrochemical stability window)을 가지며, 이 덕분에 리튬 대비 최대 6V의 양극과 같이 사용될 수 있어 고전압 전지를 구현하는데 큰 이점이 있습니다. 더욱이 리튬금속을 음극으로 사용해도 화학적으로 안정하기(compatibility) 때문에 굉장히 좋습니다.
또한, Garnet계 산화물의 열적 안정성은 산화물계 중에서 가장 높습니다. 우리가 전고체배터리를 사용하고자 하는 모든 목적에 부합하는 소재라고 생각하시면 됩니다.
하지만 단점은, 지구상 다른 광물에 비해 극히 적은 양만 존재하는 란탄(La)이 필요하고, Garnet계 산화물을 생산하기 위해서는 1000℃ 이상의 높은 소결온도가 필요하여 이 때문에 비용이 발생한다는 치명적 단점이 있습니다.
물론 이 소결온도를 낮추는 것은 가능하지만, 온도가 낮을수록 일반적으로 이온 전도도가 낮아진다는 단점이 있죠. 실온에서 최대(겨우..) 1 mS/cm의 전도도를 가진 고체전해질은 catholyte로서 적용할 수가 없죠.
3. NASICON 계
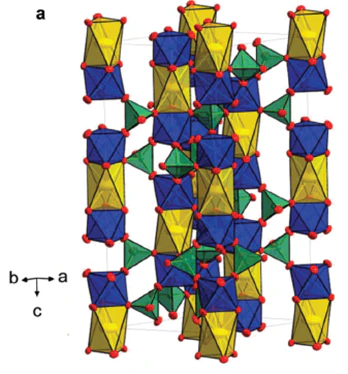
NASICON(Na Super Ionic CONductor)계 물질은 일반적으로 Na1+xZr2Si2xPxO12 (0≤x≤3)의 구조식을 가지며, 1976년 Goodenough 그룹에 의해 최초로 보고되었습니다.
이는 NaZr2(PO4)3 구조 내 일부의 이온을 Si 및 P 이온으로 치환하고 과량의 Na 이온을 도입한 형태이며, ZrO6와 PO4, SiO4가 corner-sharing으로 구조를 이루기 때문에 3차원 diffusion pathway가 형성되어 높은 전도도를 가질 수 있는 구조를 가집니다.
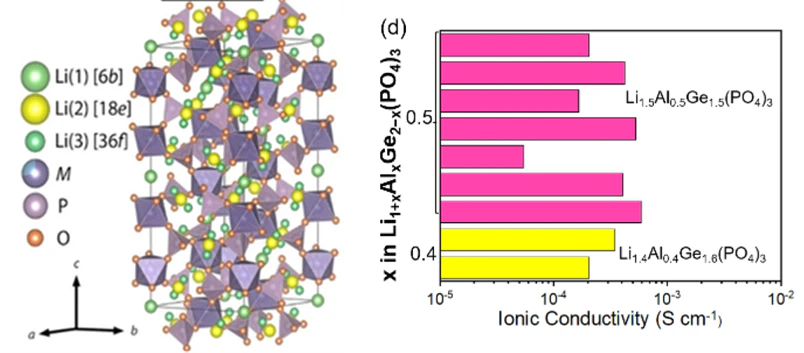
추후에 전고체배터리에 적용하기 위해 Na는 Li으로 치환하여 사용되었고, 대표적인 Li 이온 전도성 NASICON계 물질은 Li1+xAlxM2-x(PO4)3 (0<x<2, M=Zr, Ti, Ge)이며, 일반적으로 R-3c 구조를 가진다고 알려져 있습니다.
이렇듯 NASICON 계 물질 내부의 전이금속의 일부를 이온 반경이 큰 원소로 치환하여 이온전도도를 증가시킬 수 있으며, 이는 결정구조 내부의 distortion으로 인해 diffusion pathway가 확장되어 활성화에너지가 감소하기 때문으로 알려져 있죠. 예를 들어 크롬(Cr)을 첨가하여 6.65 mS/cm의 이온 전도도를 달성했다는 보고도 있습니다.
이 나시콘계의 장점은 대기안정성이 좋기 때문에 공정 단계에서 비용을 절감할 수 있으며, 소결 온도는 600~700 °C에 불과하여 이 또한 비용절감을 할 수 있습니다. 더욱이 이 타입의 고체전해질은 산화물 중에서 이온전도도가 가장 높고, 활물질층이 얇은 고출력 전지에서 catholyte로 사용하기에도 충분할 정도입니다. 또한 (5 V 이상) 양극과 같이 접목하여 사용할 수도 있습니다.
반면에 LATP의 단점은 리튬금속 음극에 대한 화학적 불안정성이 있고, LAGP도 장기적으로 Li 금속에 대한 안정성이 제한적이며 포함된 게르마늄 때문에 값이 비싸다는 큰 단점이 있습니다.
반면에, Garnet계, Perovskite계 산화물에 비해 NASICON계는 열 안정성이 좋습니다. 열폭주의 경우 LAGP 및 LATP에서 시작 온도는 약 300°C로 확인되었죠.
4. Li1+xAlxGe2-x(PO4)3 (LAGP)
이 타입은 전이금속 자리에 Ge이 치환된 구조로, LATP에 비해 electrochemical window(전위창)가 넓다는 장점이 있습니다.
하지만 리튬금속과 오랜 시간 접촉 시 표면에서 Ge이 4+에서 3+으로 환원되는 화학반응으로 인해 검은색 부산물이 생성한다는 단점이 있습니다. 이러한 부산물은 이온/전자 혼합 전도체(mixed ionic/electronic conductor)의 성격을 갖기 때문에 계면에서 추가적인 새로운 부산물들을 성장시킬 수 있으며, 반응이 가속화되면 부산물과 전해질의 부피 차이로 인해 크랙(microcrack)이 발생될 수 있습니다.
지속적으로 축적되는 크랙은 저항을 증가시키고 고체전해질을 부서지게 할 수 있어, 양극과 음극이 만나 발생하는 쇼트현상으로 화재가 발생할 수 있죠.
따라서 이러한 반응을 억제하기 위해 전해질과 Li metal 사이에 buffer layer를 삽입하여 둘의 직접적인 접촉을 막는 연구가 진행되고 있습니다.
5. Li2.9PO3.3N0.46 (LiPON)
이 타입은 1995년에 개발되었으며, Li3PO4를 N2 분위기에서 sputtering 함으로써 박막형태의 LiPON을 만들 수 있고, 10^-3 mS/cm 수준의 매우 낮은 상온 이온전도도로 인해 더 두꺼운 상태로 사용하기는 어렵다는 단점이 있습니다. 이 박막의 두께가 증가할수록 이온전도도가 급격히 하락하기 때문이죠.
다만 이러한 박막 형태로 인해 에너지밀도를 높일 수 있고, 고출력 및 급속 충전 등의 장점을 가집니다. 더욱이 전해질 구조 내의 N3-의 환원제적 성질로 인해 리튬금속과 접촉 시 매우 안정한 특성을 가집니다.
산화물계 고체전해질 별 예상 적용분야
| 산화물계 고체전해질 종류 | 가장 높은 경우의 이온전도도 | 적용분야 |
| Perovskite-type | 1 mS/cm (La0.51Li0.34TiO2.94) | 고체전해질 |
| LiPON-type | ~2 x 10^-3 mS/cm (Li3.3PO3.9N0.17) | 고체전해질 |
| NASICON-type | 3 mS/cm (Li1.3Al0.3Ti1.7(PO4)3) 6.65 mS/cm (Li1.5Al0.4Cr0.1Ge1.5(PO4)3) | 고체전해질 Catholyte |
| Garnet-type | 0.51 mS/cm (Li7La3Zr2O12) 1.8 mS/cm (Li6.65Ga0.15La3Zr1.90Sc0.10O12) | 고체전해질 |
산화물계 고체전해질 합성법
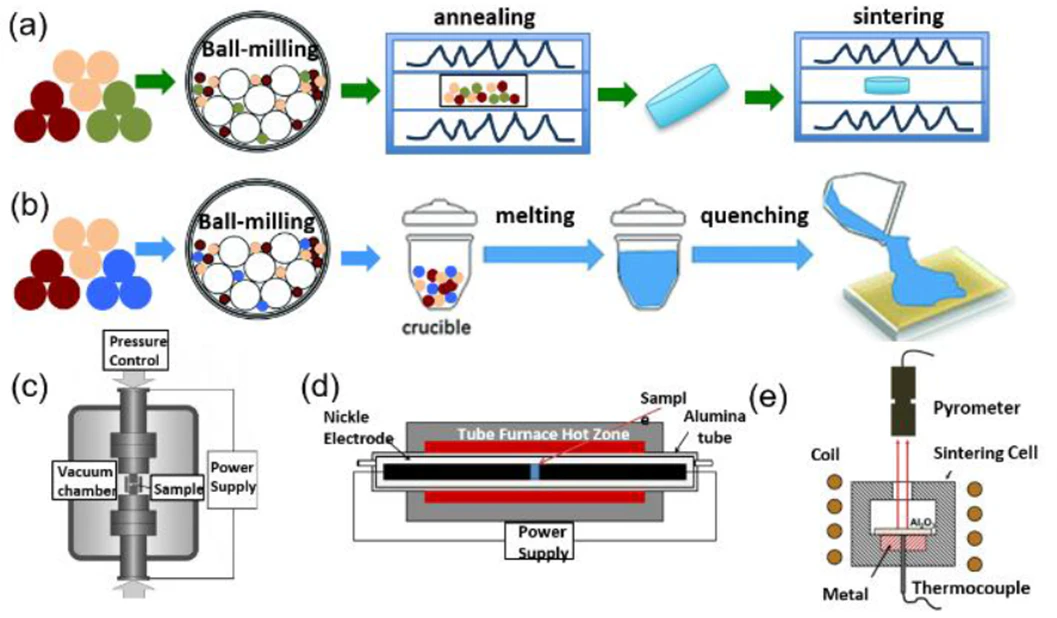
1. 고상 합성법 (Solid-phase synthesis)
일반적인 방법은 ball-milling을 이용해 입자를 혼합/분쇄 후 pellet을 만들어 700 ~ 1200°C의 고온 열처리를 통해 합성하는 방법입니다.
이 외에도 혼합된 입자들을 1500°C 이상의 고온에서 용융시킨 후 합성하는 melt-quenching 법, 방전소결법(spark sintering method), 전계소결법(field assisted sintering), 마이크로파 소결법(microwave-assisted sintering) 등의 다양한 고상합성법이 있습니다.
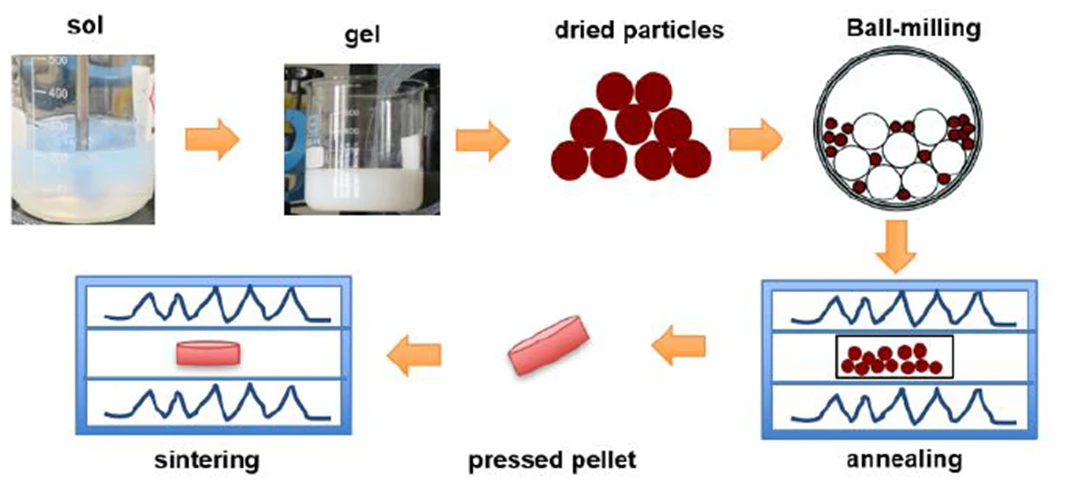
2. 액상 합성법 (Liquid-phase synthesis)
고상 합성법에 비해 소성 온도가 낮으며, 입자 크기와 형상 제어가 용이하다는 장점이 있습니다.
액상 합성법 중 흔히 사용되는 방법 중 하나로 sol-gel method(졸겔법)이 있으며, 이 방법을 이용하면 비교적 단시간 내에 균일하고 고순도의 전해질 합성이 가능합니다.
또한 대량 합성이 가능하기 때문에 졸겔법을 이용해 95%의 순도를 가지는 1kg의 LATP를 합성할 수 있고, 원료나 용매 종류, 열처리 조건 등에 따라 최종 합성되는 전해질의 이온전도도나 결정구조 등의 특성에 영향을 줄 수 있습니다.
다음 시간에는..
고체전해질 마지막 타입인 고분자계에 대해 말씀드리겠습니다.
다만 현재는 고분자로만 사용하진 않고 중국에서 많이 사용하고 있는 형태인 반고체 형태로 많이 사용한다는 점! 아래 글을 참고해 주세요~
전고체배터리(ASSB) 중, 반고체전지란? (Semi-solid 배터리)
LIB와 ASSB의 사이, Semi-solid 전고체전지 가기 전 단계인 반고체전지 '24년 NGBS tutorial 두 번째 시간입니다. (제가 가지고 있던 자료와 NGBS 자료를 좀 섞어서 설명드리겠습니다.) 반고체전지, 하이브리
wearethebattery.tistory.com
읽어주셔서 감사합니다.
여러분의 구독과 하트는 지속적인 글 쓰는 데 큰 힘이 됩니다 :)
자세한 사항을 원하시면 아래의 메일로 연락 주세요.
wearethebattery@gmail.com
'전기차 및 배터리 시장' 카테고리의 다른 글
| 전고체배터리(ASSB) : 글로벌 특허 현황 (0) | 2024.05.08 |
|---|---|
| 기술성숙도 (Technology Readiness Level; TRL) (0) | 2024.05.07 |
| 전고체배터리(ASSB) : 산화물계 고체전해질 장점과 단점 (0) | 2024.05.03 |
| 배터리 시장 : 글로벌 ESS(에너지 저장 시스템) - 산업 환경분석 (0) | 2024.04.29 |
| 배터리 시장 : 글로벌 ESS(에너지 저장 시스템) - 시장 분석 (0) | 2024.04.28 |



